原子序数周期族的含义,元素表的周期是什么意思
发布:小编
原子序数周期族的含义
1、原子序数:指元素在周期表中的序号,符号为Z,在数值上等于原子核的核电荷数(即质子数)或中性原子的核外电子数。例如碳的原子序数是6,它的核电荷数(质子数)或核外电子数也是6。
2、周期:主要是指元素的核外电子排布随着核电核数的递增呈周期性的变化,如第二周期最外层是从1到8,第三周期重复这一过程,也是1到8。之后的也是一样,只是有些复杂。再根据性,构,位一体的原则,也会出现周期性的变化,即根据核外电子排布周期性变化。
3、族:原子最外层电子数相同的所以元素的集合,周期表中的每一纵列。
元素表的周期是什么意思
问题一:元素周期表 中的 周期是什么意思 周期是指元素存在着周期性的变化规律,其主要原因是最外层电子数目的变化
问题二:元素呈周期性变化是什么意思? 结合元素周期表,元素周期律可以表述为:
随着原子序数的增加,元素的性质呈周期性的递变规律:
在同一周期中,元素的金属性从左到右递减,非金属性从左到右递增,
在同一族中,元素的金属性从上到下递增,非金属性从上到下递减;
同一周期中,元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右逐渐增高;
同一族的元素性质相近。
具有同样价电子构型的原子,理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因。
以上规律不适用于稀有气体。
此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充:
着从左到右价层轨道由空到满的逐渐变化,元素也由主要显金属性向主要显非金属性逐渐变化。
随同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性。
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。
元素的最高价氢氧化物的碱性越强,元素金属性就越强;最高价氢氧化物的酸性越强,元素非金属性就越强。
元素的气态氢化物越稳定,非金属性越强。
同一周期元素原子的半径从左向右递减,同一族元素半径从上到下递增(稀有气体除外)
还有一些根据元素周期律得出的结论:
元素的金属性越强,其第一电离能就越小;非金属性越强,其第一电子亲和能就越大。
同一周期元素中,轨道越“空”的元素越容易失去电子,轨道越“满”的越容易得电子
问题三:元素周期表中"周期"和"族"是什么意思 周期是横排,
族是纵列
第一根据电子层数
第二根据最外层电子数目
以及性质
问题四:元素周期表中的周期数和族序数分别指的是什么 元素周期表中,横行叫周期。七个横行七个周期;纵行叫族,不过十八个纵行只有十六个族(第八、九、十这三个纵行是一个族)
周期数和族序数分别指的是第几周期、第几族
问题五:元素周期表 族 周期是什么意思 族就是最外层电子数相同的放在一起
每一个纵列.共16个族.其中第八族占了3列,因此共18个纵列
主族(7个7列)副族(7个7列)第八族(1个3列)0族(1个1列.即稀有气体)
族数=最外层电子数
周期就是电子层数相同的放在一起
每一条横行.共7个周期
短周期(3个3行.分别为2.8.8个元素)长周期(3个3行)不完全周期(1个1行)
周期数=电子层数
元素周期律51号是什么意思
1.元素周期律指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的递增呈周期性变化的规律。
2.结合元素周期表,元素周期律可以表述为:元素的性质随着原子序数的递增而呈周期性的递变规律。
3.元素呈现种种物理性质上的周期性,例如随着元素原子序数的递增,原子体积呈现明显的周期性,在化学性质方面,元素的化合价、电负性、金属和非金属的活泼性。
结合元素周期表,元素周期律可以表述为:元素的性质随着原子序数的递增而呈周期性的递变规律。随着原子序数的增加,元素的性质呈周期性的递变规律: 在同一周期中,元素的金属性从左到右递减,非金属性从左到右递增。
在同一族中,元素的金属性从上到下递增,非金属性从上到下递减; 同一周期中,元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右逐渐增高; 同一族的元素性质相近。 主族元素同一周期中,原子半径随着原子序数的增加而减小。
同一族中,原子半径随着原子序数的增加而增大。如果粒子的电子构型相同,则阴离子的半径比阳离子大,且半径随着电荷数的增加而减小。
以上就是关于原子序数周期族的含义,元素表的周期是什么意思的全部内容,以及原子序数周期族的含义的相关内容,希望能够帮到您。
版权声明:本文来自用户投稿,不代表【推酷网】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:350149276@qq.com)我们将及时处理,共同维护良好的网络创作环境。
大家都在看

描写秋月古诗,描写秋月的诗句
综合百科描写秋月的诗句1、一弹流水一弹月,半入江风半入云。——对联2、举杯邀明月,对影成三人。——李白3、更深月色半人家,北斗阑干南斗斜。——刘方平4、我寄愁心与明月,随君直到夜郎西。——李白5、小时不识月,呼作白玉盘。——李白6、花间一壶酒,独酌无相亲。举杯邀明月,对影成三人。——李白
科目四包过方法,科目一一般几天能过
综合百科本文目录1.科目一一般几天能过2.科目四可以花钱买过吗3.科目一vip500道题包过吗4.考驾照vip包过是真的吗科目一一般几天能过科目四考试与科目一类似,从学员考试情况来看,算是驾考中通过率最高的一科,因为有了前面科目的驾驶常识和方法经验,题目做起来也较为轻松。既然如此,那科目
和平精英跳伞跟随是怎么分配的,和平精英自动跟随跳伞怎么关闭
综合百科和平精英跳伞跟随是怎么分配的和平精英中,玩家可以使用跳伞跟随功能自动跟随队友跳伞,许多玩家还不知道跳伞跟随是怎么分配队友的,下面就来告诉大家,希望对大家有所帮助。游戏设置中的【默认跳伞跟随】功能是随机分配队友跳伞的,玩家在设置里打开【跳伞自动跟随】功能后,组队模式下会随机跟随队友

win7系统的设置在哪里,电脑高级设置在哪里win7
综合百科win7系统的设置在哪里可以通过高级设置来提高电脑性能,方法如下:方法一:1、点击开始,右键点击计算机,属性,高级设置,来到高级系统设置面板。2、选择高级设置。来到设置面板。3、勾选自定义,然后将所有特效全部取消。点击确定即可。4、对比一下设置前后,两者在美观上差很多,但是电脑的

古丝绸之路的西域古国是哪,唐朝时西域有哪些国家
综合百科本文目录1.唐朝时西域有哪些国家?2.西域鄯善的演变历史3.新疆在古代称为西域吗4.丝绸之路东西两端的文明古国唐朝时西域有哪些国家?1、楼兰楼兰,是西域古城遗迹。最早见于《史记》,曾经为丝绸之路必经之地,现只存遗迹,地处新疆巴音郭楞蒙古自治州若羌县北境,罗布泊的西北角、孔雀河道南

励志光明的语录,励志名言警句摘抄大全1000条
综合百科励志光明的语录既然生命是从光明回归黑暗的过程,那么生命还有什么意义?生命的意义在于,活着的每一天,都是在为了挣脱黑暗而努力着。白昼之光,岂知夜色之深。你说周围很黑暗,你说环境很压抑,可我想告诉你,种子发芽之前也是这么说的。 励志名言警句摘抄大全1000条1、最黑暗的时刻也是最接

锋火儿女情大结局,烽火逃兵电视剧什么时候上映
综合百科锋火儿女情大结局1、《烽火儿女情》结局:康康醒来,俊杰着急要他叫自己爸爸,不想康康只认浩然,让俊杰伤心。浩东墓前,安妮与嘉丽,志炜相遇,看开一切的嘉丽和安妮相拥在一起。2、雨涵要求和浩然结婚,浩然拒绝,只是因为想着如果自己能够活着从前线回来,两人能够重新开始。浩然和俊杰冲上前线,

哺乳期能吃香菜,哺乳期可以吃香菜
综合百科哺乳期可以吃香菜吗?一、哺乳期可以吃香菜它的营养价值高,哺乳期是可以吃的。里面含有维生素C,维生素B1,B2,胡萝卜素,且还含有矿物质,例如磷,镁,铁,钙等,挥发油的含量也很高,因此可促进肠胃蠕动,能开胃。若是食欲不佳或者是便秘的可适量食用。不过食用的时候一定要注意量,尽量少吃。

微爱怎么删除照片,微爱上面设置的记录怎么删除
综合百科微爱怎么删除照片微爱删除照片的方法是点击图片到最大化,点击右下角删除选项即可,微爱是一款专为情侣设计的甜蜜应用,可以用微爱和爱人一对一私密聊天,发图片,发位置。照片,指用感光纸放在照相底片下曝光后经显影、定影而成的人或物的图片。写真多指艺术摄影,俗称艺术照写真集,又可以泛指照片。

农业银行办信用卡需要什么资料,农业银行办信用卡需要什么资料
综合百科本文目录1.农业银行办信用卡需要什么资料?2.办理农业银行信用卡需要提交哪些资料呢3.农行信用卡面签需要带什么材料去4.中国农业银行办理信用卡需要什么条件农业银行办信用卡需要什么资料?农业银行办理信用卡需要的资料有:1、个人身份证原件和复印件;2、个人收入证明,可以是单位出具的证

金钱经典语录励志,有关土豪的经典语录
综合百科有关土豪的经典语录土豪不可怕,可怕的是TA是一个比你还要努力的土豪。屌丝不可悲,可悲的是TA是一个爱伪装成土豪的屌丝。“帮我充下话费”“充多少?”“充满”算了吧,像你这样的人,就算把土豪两个字贴在你脸上,别人也会从右边开始念起。 金钱经典语录励志1、金钱是海水,越喝越渴。2、男
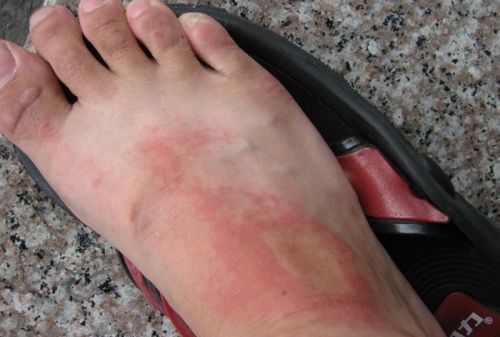
脚背痒是怎么回事,脚背无故肿痛
综合百科本文目录1.脚背无故肿痛2.脚背经常痒是什么原因引起的3.一到夏天脚背上就容易长湿疹怎么回事4.喝酒后脚背痒痒是何原因脚背无故肿痛病情分析:你好,根据你的描述,这不排除是皮肤过敏的可能哦,一般认为敏感性皮肤是一种高度不耐受的皮肤状态,易受到各种因素的激惹而产生刺痛、烧灼、紧绷、瘙









